CAR-T&TCR-T细胞疗法介绍
细胞治疗是指获取人自体或异体来源的具有特定功能的活细胞,经体外操作后输入人体,达到治疗某种疾病的目的。根据细胞类型的不同,可以分为免疫细胞治疗、干细胞治疗及其他细胞治疗。
CAR-T和TCR-T都属于比较主流的特异性免疫细胞治疗,且细胞来源相同,均来自外周血单核细胞(PBMC)、自体或同种异体细胞。
CAR-T细胞疗法的作用机制是利用慢病毒(LV)等作为递送载体,将CAR基因序列转移到T细胞基因组,使T细胞特异性识别并结合肿瘤细胞,然后通过释放穿孔素等因子杀伤肿瘤细胞,从而达到治疗目的。其具有杀肿瘤效果好、治疗效果持久、适用高龄人群也适宜联合用药等优势。
TCR-T细胞疗法的作用机制是先从患者血液或肿瘤组织中分离出T细胞,然后从单个T细胞克隆中分离出TCRα和β链,并插入慢病毒或逆转录病毒载体中,再进行病毒转染T细胞,将目标TCRαβ序列引入T细胞中,获得能够特异性识别肿瘤抗原的TCR-T细胞,这些经过修饰的T细胞随后在体外扩增,以获得足够的数量用于治疗和重新输回患者体内。TCR-T疗法具有较强的靶向性、渗透性和稳定性等优势。
CAR-T和TCR-T均因能够表达特异性受体,靶向识别特异性的细胞如肿瘤细胞,受到广泛的关注和研究。但这两种疗法在抗肿瘤和缓解患者疾病的同时,也会引发细胞因子风暴和神经毒性等副作用。因此,国家药监局等国内外监管机构对免疫细胞治疗产品制定了一系列的指导原则和指南等,来规范和指导免疫细胞治疗产品的研发、申报和评价。
CAR/TCR拷贝数检测概念及法规监管要求
拷贝数是指某基因(可以是质粒)在某一生物的基因组中的个数。单拷贝就是该基因在该生物基因组中只有一个,多拷贝则指有多个。
已知CAR-T和TCR-T细胞治疗,均是将含有CAR或TCRαβ序列的目的基因构建到慢病毒或逆转录病毒载体中,然后进行病毒感染T细胞,获得CAR-T或TCR-T细胞。这些载体基因整合在T细胞基因组中,一方面显示有T细胞进行了CAR或TCR基因修饰,一方面又是一个安全性指标,可能会因整合而带来原癌基因的激活或抑癌基因的失活等造成二次肿瘤的风险。尽管现在载体的设计已经大大降低了整合的风险,但这种风险仍未完全消除,因此需要对整合到细胞基因组中的病毒载体拷贝数进行检测。
针对CAR和TCR基因整合带来的潜在风险,国内外的药品监管相关机构都发布了相应的指导性文件。
2018年6月,中国食品药品检定研究院颁发的《CAR-T细胞治疗产品质量控制检测研究及非临床研究考虑要点》明确规定CAR基因拷贝数≤5 copies/细胞。

美国FDA也于2022年3月15日发布了《嵌合抗原受体(CAR)T细胞治疗的研发考量》指南草案,提到载体拷贝数转基因整合可能改变细胞基因的表达,并导致致瘤性。因此,制剂中的转基因整合是衡量CAR-T和TCR-T等细胞放行的重要安全参数。
CAR/TCR基因拷贝数检测
目前,实时荧光定量PCR(qPCR)广泛用于基因表达、拷贝数确定和病原体检测研究等,这种方法可以准确定量样品中DNA或RNA的核酸靶序列数量。因此,CAR和TCR等转基因拷贝数的检测行业内也普遍采用qPCR的方法。
CAR/TCR基因拷贝数的检测,主要包括CAR-T或TCR-T细胞悬液收获阶段和接受CAR-T或TCR-T细胞治疗的患者定期取外周血随访监测阶段。
针对上述情况,翌圣生物自主研发了CAR/TCR基因拷贝数检测试剂盒,采用多重荧光探针qPCR法分别检测CAR-T或TCR-T细胞基因组中CAR或TCR基因的拷贝数以及人体细胞中单拷贝基因(Single Copy Gene, SCG)。还研发了与之配套使用的宿主细胞残留DNA样本前处理试剂盒,以及配套的自动化核酸提取仪器。
下图就CAR/TCR基因拷贝数检测工作流程,进行了详细介绍:
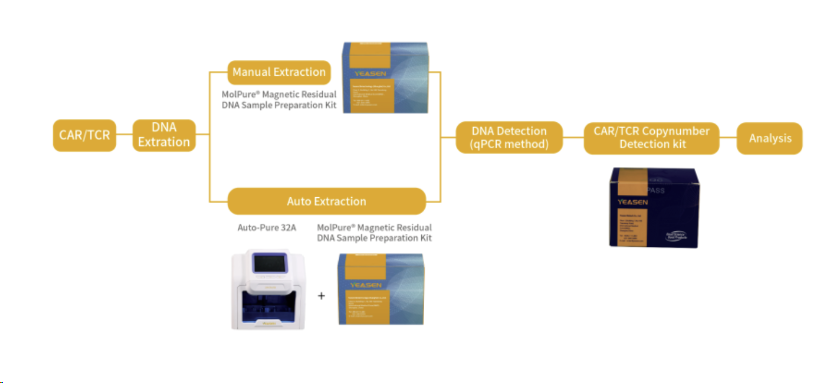
CAR/TCR基因拷贝数检测Kit产品性能
符合法规:按照法规要求进行全面验证,可提供验证报告;
保障品质:试剂盒原材料全自主研发,qPCR Mix等酶产品在超洁净酶工厂生产;
灵敏度高:定量限可达101copies/μL水平;
精密度高:批内重复性高,批间差异小;
专属性强:特异性检测CAR或TCR基因拷贝数,不受其他外源基因组DNA干扰;
防干扰强:添加内部对照(IC),便于排除样本干扰、反应配制异常等因素
产品信息

参考文献
[1] 中国食品药品检定研究院,CAR-T细胞治疗产品质量控制检测研究及非临床研究考虑要点,2018.
[2] FDA.Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products Draft Guidance for Industry,March 2022.Docket Number:FDA-2021-D-0404.Issued by:Center for Biologics Evaluation and Research.
[3] Kunz A, Gern U, Schmitt A, et al. Optimized Assessment of qPCR-Based Vector Copy Numbers as a Safety Parameter for GMP-Grade CAR T Cells and Monitoring of Frequency in Patients. Mol Ther Methods Clin Dev. 2020 Feb 20; 17:448-454. doi: 10.1016/j.omtm.2020.02.003. PMID: 32201711; PMCID: PMC7078460.
