基因敲除技术
一.概述:
基因敲除是自80年代末以来发展起来的一种新型分子生物学技术,是通过一定的途径使机体特定的基因失活或缺失的技术。通常意义上的基因敲除主要是应用DNA 同源重组原理,用设计的同源片段替代靶基因片段,从而达到基因敲除的目的。随着基因敲除技术的发展,除了同源重组外,新的原理和技术也逐渐被应用,比较成功的有基因的插入突变和iRNA ,它们同样可以达到基因敲除的目的。
二.实现基因敲除的多种原理和方法:
1.利用基因同源重组进行基因敲除
基因敲除是80年代后半期应用DNA 同源重组原理发展起来的。80年代初,胚胎干细胞(ES细胞)分离和体外培养的成功奠定了基因敲除的技术基础。1985年,首次证实的哺乳动物细胞中同源重组的存在奠定了基因敲除的理论基础。到1987年,Thompsson首次建立了完整的ES细胞基因敲除的小鼠模型[1]。直到现在,运用基因同源重组进行基因敲除依然是构建基因敲除动物模型中最普遍的使用方法。
(1)利用同源重组构建基因敲除动物模型的基本步骤(图1):
①. 基因载体的构建:把目的基因和与细胞内靶基因特异片段同源的DNA 分子都重组到带有标记基因(如neo 基因,TK 基因等)的载体上,成为重组载体。基因敲除是为了使某一基因失去其生理功能,所以一般设计为替换型载体。
②.ES 细胞的获得:现在基因敲除一般采用是胚胎干细胞,最常用的是鼠,而兔,猪,鸡等的胚胎干细胞也有使用。常用的鼠的种系是129及其杂合体,因为这类小鼠具有自发突变形成畸胎瘤和畸胎肉瘤的倾向,是基因敲除的理想实验动物。而其他遗传背景的胚胎干细胞系也逐渐被发展应用。[2,3]
③.同源重组:将重组载体通过一定的方式(电穿孔法或显微注射)导入同源的胚胎干细胞(ES cell)中,使外源DNA 与胚胎干细胞基因组中相应部分发生同源重组,将重组载体中的DNA 序列整合到内源基因组中,从而得以表达。一般地,显微注射命中率较高,但技术难度较大,电穿孔命中率比显微注射低,但便于使用。[4,5]
④.选择筛选已击中的细胞:由于基因转移的同源重组自然发生率极低,动物的重组概率为10-2 ~10-5 ,植物的概率为10-4 ~10-5 。因此如何从众多细胞中筛出真正发生了同源重组的胚胎干细胞非常重要。目前常用的方法是正负筛选法(PNS法),标记基因的特异位点表达法以及PCR 法。其中应用最多的是PNS法。[6]
⑤.表型研究:通过观察嵌和体小鼠的生物学形状的变化进而了解目的基因变化前后对小鼠的生物学形状的改变,达到研究目的基因的目的。[2,3,7]
⑥.得到纯合体:由于同源重组常常发生在一对染色体上中一条染色体中,所以如果要得到稳定遗传的纯合体基因敲除模型,需要进行至少两代遗传。[8](见图2)
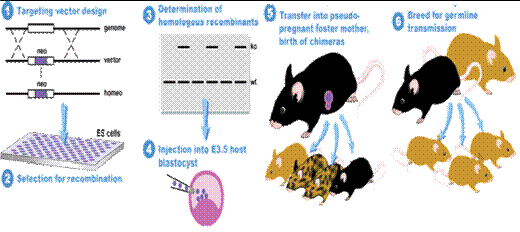
图1
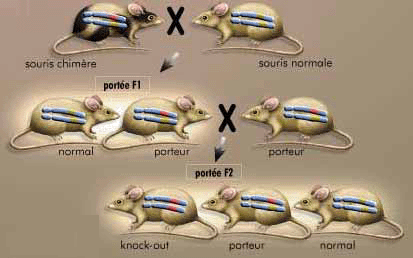
图2
(2)条件性基因敲除法
条件性基因敲除法可定义为将某个基因的修饰限制于小鼠某些特定类型的细胞或发育的某一特定阶段的一种特殊的基因敲除方法[2]。它实际上是在常规的基因敲除的基础上,利用重组酶Cre介导的位点特异性重组技术,在对小鼠基因修饰的时空范围上设置一个可调控的“按钮”,从而使对小鼠基因组的修饰的范围和时间处于一种可控状态。
条件性敲除的原理:
利用Cre/LoxP 和来自酵母的FLP—frt 系统可以研究特定组织器官或特定细胞中靶基因灭活所导致的表型[7]。通过常规基因打靶在基因组的靶位点上装上两个同向排列的1oxP,并以此两侧装接上loxP 的(“loxP floxed”)ES 细胞产生“loxPfloxed”小鼠,然后,通过将“loxP floxed”小鼠与Cre 转基因鼠杂交(也可以其他方式向小鼠中引入Cre 重组酶),产生靶基因发生特定方式(如特定的组织特异性)修饰的条件性突变小鼠。在“loxP floxed”小鼠,虽然靶基因的两侧已各装上了一个loxP,但靶基因并没有发生其他的变化,故“1oxP noxed”小鼠表型仍同野生型的一样。但当它与Cre 转基因小鼠杂交时,产生的子代中将同时带有“loxP floxed”靶基因和Cre 基因。Cre 基因表达产生的Cre 重组酶就会介导靶基因两侧的1oxP 间发生切除反应,结果将一个loxP 和靶基因切除。这样,靶基因的修饰(切除)是以Cre 的表达为前提的。Cre 的表达特性决定了靶基因的修饰(切除)持性:即Cre 在哪一种组织细胞中表达,靶基因的修饰(切除)就发生在哪种组织细胞;而Cre 的表达水平将影响靶基因在此种组织细胞中进行修饰的效率。所以只要控制Cre 的表达特异性和表达水平就可实现对小鼠中靶基因修饰的特异性和程度[9,10]。
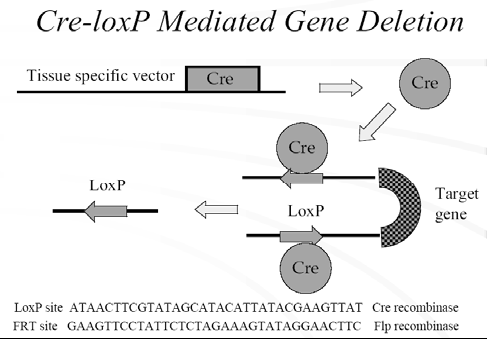
图3
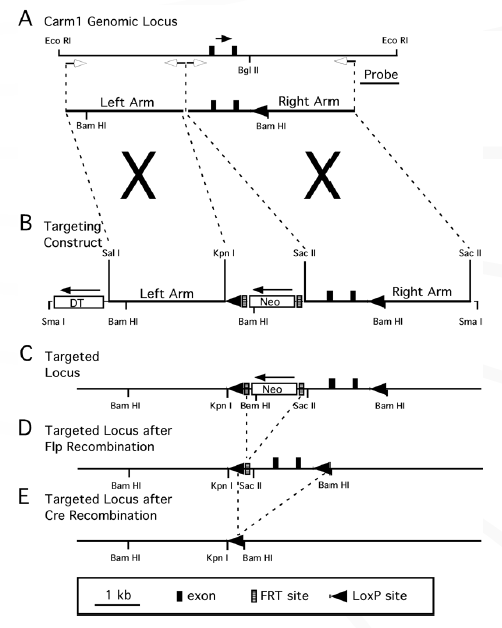
图4
(3)诱导性基因敲除法
诱导性基因敲除也是以Cre/loxp 系统为基础,但却是利用控制Cre 表达的启动子的活性或所表达的Cre 酶活性具有可诱导的特点,通过对诱导剂给予时间的控制或利用Cre 基因定位表达系统中载体的宿主细胞特异性和将该表达系统转移到动物体内的过程在时间上的可控性,从而在1oxP 动物的一定发育阶段和一定组织细胞中实现对特定基因进行遗传修饰之目的的基因敲除技术。人们可以通过对诱导剂给予时间的预先设计的方式来对动物基因突变的时空特异性进行人为控制、以避免出现死胎或动物出生后不久即死亡的现象。常见的几种诱导性类型如下:四环素诱导型(图4);干扰素诱导型;激素诱导型;腺病毒介导型。
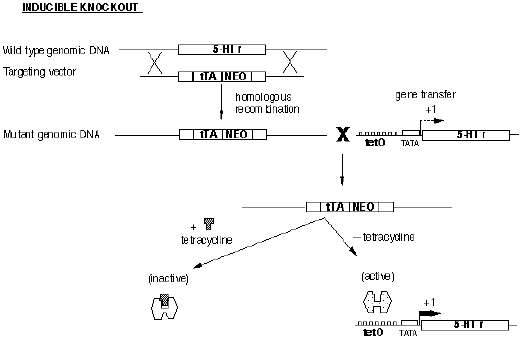
图5.四环素诱导的基因敲除过程示例图
诱导性基因敲除优点:
① 诱导基因突变的时间可人为控制;
② 可避免因基因突变而致死胎的问题
③ 在2 个loxP 位点之间的重组率较高;
④如用病毒或配体/DNA 复合物等基因转移系统来介导Cre 的表达,则可省去建立携带Cre 的转基因动物的过程。[10]
2.2利用随机插入突变进行基因敲除。
此法利用某些能随机插入基因序列的病毒,细菌或其他基因载体,在目标细胞基因组中进行随机插入突变,建立一个携带随机插入突变的细胞库,然后通过相应的标记进行筛选获得相应的基因敲除细胞(原理见图5)[11,12] 。根据细胞的不同,插入载体的选择也有所不同。逆转率病毒可用于动植物细胞的插入;对于植物细胞而言农杆菌介导的T-DNA转化和转座子比较常用;噬菌体可用于细菌基因敲除。
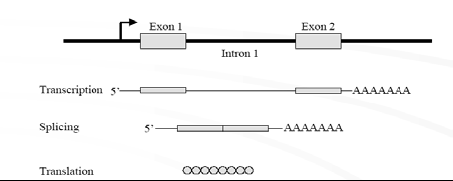
.需要敲除的靶基因转录翻译出活性蛋白
插入了靶目标的基因转录翻译出无活性的目标蛋白随机插入内含子中
.需要敲除的靶基因转录翻译出活性蛋白
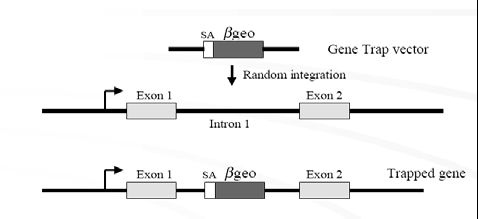
图6:基因捕获法的基本原理图
基因捕获法是最近发展起来的利用随机插入突变进行基因敲除的新型方法,其原理可见图6。通常基因捕获载体还包括一个无启动子的报道基因,通常是neo 基因,neo
地 址: 北京市朝阳区化工路5号西院 鑫企旺写字楼302室 联系人: 李先生 电 话: 010-84766480 传 真: 010-84766490 Email:powerroad@yeah.net
北京力途科技有限公司
商家主页
