hERG K+通道电流和药理学特性
简介
HERG (human ether-a go-go-related gene) K+ 通道在心脏中高表达,是心肌动作电位三期快速复极化电流(IKr)的主要组成部分(Curran ‘95; Sanguinetti ‘95)。hERG 突变引起的功能缺失常伴随一些遗传性长QT 综合症(LQTS) 并且会增加发生严重的室性心律失常, 扭转性实行心动过速 (Tanaka ‘97; Moss ‘02)的风险。HERG 钾离子通道被作用于心脏或非作用于心脏的药物抑制,都被证实有非常大的可能性出现获得性药物诱导的长QT 综合症(LQTS),甚至导致猝死(Vandenberg, Walker & Campbell ‘01)。实际上,hERG 钾离子通道被抑制引起的副作用是近年来药物撤市的要原因,因而药物作用于外源性表达于哺乳动物细胞的hERG 通道的体外效应评价已被 国际药品注册协调会议(International Conference on Harmonization)推荐作为临床前安全性评价工作的一部分(ICHS7B Expert Working Group, ‘02)。hERG 钾离子通道药物效应评价的金标准方法是手动膜片钳记录。然而,这种低通量、高成本的方法在大量的安全性筛选实验中非常受限制。近年来,全自动膜片钳技术发展越来越成熟,可以获得高通量的、可与手动膜片钳记录结果相媲美的数据。IonFlux™ 系统结合了读板机的便捷和传统膜片钳技术的优秀性能。本文主要利用IonFlux 系统记录了在哺乳细胞中表达的hERG 电流以及一些阳性抑制剂对hERG 阻断效应的药理学特性分析。
材料和方法
细胞
实验中使用G418 筛选的稳定表达hERG 通道的CHO 细胞(Millipore PrecisION™ hERG-CHO Recombinant Cell Line, Cat# CYL3038)。细胞培养在含10%胎牛血清的Glutamax DMEM/F12 培养基 (Gibco,Cat# 11320) ,加有1% 青霉素-链霉素以及500 μg/mL G418。实验前至少提前24 小时将细胞转移至30℃培养箱中,或传代后一直放置在30℃培养箱中。细胞密度不能超过90%。收集细胞时,使用Detachin(Genlantis, San Diego, CA, Cat# T100100)消化细胞,冲洗并轻柔吹打,最后细胞悬浮在细胞外液中,浓度为每毫升2-5 百万个细胞。
溶液和化合物
细胞外液成分(ECS)含有(mM):NaCl 145, KCl 4, MgCl2 1, CaCl2 2,HEPES 10, 葡萄糖 10,用NaOH 调pH 至7.4 。细胞内液成分(ICS)含有(mM):KCl 120, HEPES 10, Na2ATP 4, EGTA 10, CaCl2 5.374,MgCl2 1.75,用KOH 调pH 至7.2。
hERG 抑制剂购自Sigma。化合物第一步全部溶于DMSO 中,制成高浓度的母液(10-50 mM),然后按照浓度梯度和最终外液中的终浓度的倍数关系进行下一步的稀释,因而最终相应的DMSO 浓度为(0.1- 0.3%)。DMSO 溶液(0.1- 0.3%)作为阴性对照的记录始终开始于抑制剂作用之前,且规定不能对电流幅度的影响超过10%。

Figure 1. IonFlux 高通量全自动膜片钳系统,采用“读板机”式模式,简化了工作流程、增加了实验通量。系统配有16 通道和64 通道两种型号,每天可以记录获取10,000 个数据点。
实验刺激方案
IonFlux记录板的每个孔分别加入250 μL内液、化合物、以及细胞悬液。IonFlux记录板的规格和加液处理与标准的多孔板完全一致,主要区别之处在于记录板的底部加装了互相独立的微流体孔道网络用于连接、运送试验孔中不同的液体。在溶液添加结束后,所有气压控制步骤全部通过机器自身来完成,包括细胞捕获、形成封接、化合物添加,以及冲洗等。
IonFlux-16系统包含了16个独立的放大器。编辑好的电压刺激命令同步作用于所有的16个记录通道。系统采用20个细胞集合记录的模式,即一个放大器对应的记录位点中同时记录20个细胞的电流结果并取其总和值作为最终的数据,从而大大提高数据的一致性以及实验成功率。在本次hERG实验中,细胞被钳制在-80mV,且超极化至-100mV以监控串联电阻的变化。hERG在+50mV(800ms)被激活,然后外向尾电流在-50mV时被记录,激活前-50mV的刺激将作为基线电流用于最终结果的分析。-50mV之后继续超极化至-120mV(800ms)主要用于hERG通道从失活过程的恢复(见图2)。在研究电压-电流关系(IV反应)的实验中,采用了从-50mV至60mV 12个10mV步阶激活刺激命令,或者从-120mV至+50mV的18个10mV的去极化步阶刺激命令(见图3)。电压刺激命令每隔6秒运行一次。漏电流通过在线的两组小脉冲来补偿(-80mV至-100mV,50ms/50ms)。采样频率为5kHz,实验在室温中进行(20-23°C)。
在药理学特性研究中,hERG电流稳定后(~5min),同一个化合物按照浓度从低到高(包括0.1-0.3%DMSO溶液的阴性对照)依次添加至细胞记录位点,持续3~5分钟。加样方式包括依次累加给药刺激或每个浓度间隔外液冲洗两种方式。
全细胞 hERG 离子通道电流示例
图2显示了电压刺激方波(上图)和典型的室温下hERG离子通道实时电流软件截屏图(下图)。图中16个放大器对应的16个通道的hERG电流结果在展现在一张图中,以不同颜色表示。漏电流补偿通过机器自动完成。电阻和电流的幅度(I) 通过标记的游标(cursor)位置(粉色和亮绿色用于电阻的计算,绿色和蓝色用于电流计算)进行统计计算。
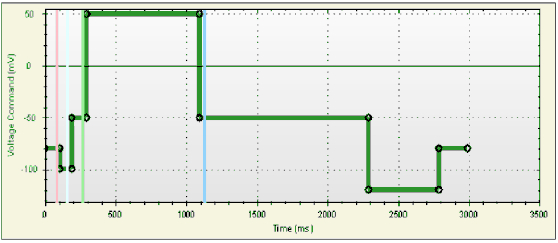
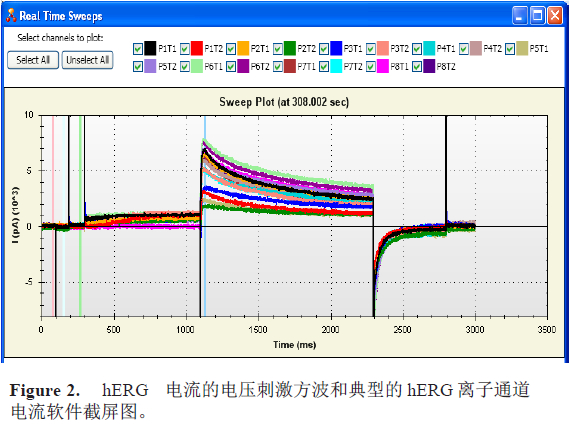
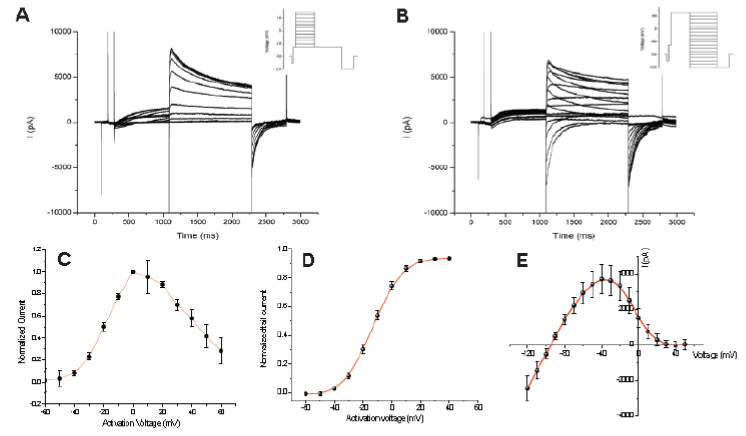
Figure 3. 室温下记录的hERG 电流的电压-电流关系。细胞钳制在-80 mV。(A) 显示了一个典型的不同激活步阶电压下记录到的hERG 电流。激活电流的IV 点线图和-50mV 尾电流的电压激活曲线图分别展现于(C)和(D)。全部hERG 细胞全激活的电流图和IV 点线图分别显示在 (B) 和(E)。
hERG 电流的电压依赖性记录
室温下记录的hERG 电流的电压-电流关系显示于图3。细胞钳制在-80 mV。图3 的A 图显示了一个典型的不同激活步阶电压下记录到的hERG 电流。 细胞从–60 mV 至 60 mV 逐渐去极化,持续时间800 ms,以激活hERG 电流, 然后再复极化至-50 mV 以记录外向尾电流。激活电流的IV 点线图和-50mV 尾电流的电压激活曲线图分别展现于(C)图和(D)图。Boltzmann 方程拟合的电压激活曲线得到的半数最大电流的激活电压是–6±0.3mV(D 图)。此数据结果与之前发表的全自动膜片钳结果一致(PatchX- press, Guo & Guthrie, 2005),且与23 °C 条件下记录的手动膜片钳结果相比较大约偏移了8mV左右(-14mV, Zhou et al., 1998)。全部hERG 细胞全激活的电流图和IV 点线图分别显示在 (B 图) 和(E 图),电流在去极化至50mV 的步阶刺激中被激活,然后复极化至不同电压水平。尾电流-94 mV 时被翻转;在更副的电压水平下电流变为内向。
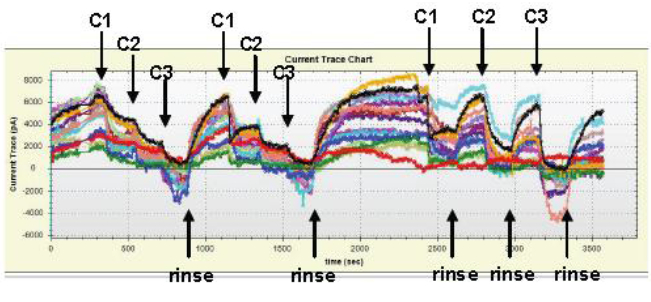
Figure 4. 长时间hERG 记录和两种化合物添加方式。实验软件截屏图显示了两个化合物的依照浓度梯度累积给药,以及随后每个浓度间隔外液冲洗后再给药的方式。
hERG 抑制剂的 IC50
获得全细胞模式后,hERG 电流可以持续记录超过60 分钟(最多120 分钟)(见图4 示例)。因而,在同一种细胞上两种不同加样方式均可以用来检测化合物的IC50 值。
每个试验区同一个细胞最多可以检测包含最多8 个化合物。图4 中显示的示例点线图展示了两种不同的量效实验模式。C1、C2、和C3 代表从低到高的三个不同浓度(在不同试验区中可以是相同或不同的浓度) 。首先,C1、C2、C3 在依次累积加样方式下分别重复2 次给药, 然后再按照每个浓度间隔外液冲洗后再给药的方式加样(Fig. 4)。 顺序给药不同浓度后( 依次累加或间隔冲洗) 均导致了h E R G 电流在每个浓度产生相似的抑制率在本次实验中,两种不同的化合物(阿米替林和西沙比利,Amitriptyline 和Cisapride)被添加在记录板的不同试验区。其IC50 值来自于各自独立的细胞产生的量效曲线的拟合和计算。
多个已知得得hERG 抑制剂的IC50 值来自于图5 所示例电费Hill 方程的曲线拟合。其结果与文献报道的数据在表1 中进行了比较。
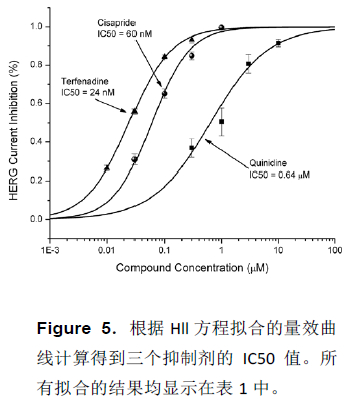
讨论
本实验成功验证了IonFlux平台在hERG钾电流研究和hERG通道抑制化合物筛选等方面的应用。多细胞的集合记录展现出了更高的成功率和电流更稳定的优势,特别在长时间持续记录时。hERG电流的激活和失活表现出了与手动膜片钳记录结果相似的电压依赖性特点。由于hERG电流的长时间记录(>60分钟)、化合物的快速加样和冲洗、以及加样过程中电压依赖性电流连续监控等特点,可以在一次实验中同样的细胞条件设置下得到多个化合的IC50值。IonFlux平台记录获得的IC50值与文献报道的结果是一致的(Redfern‘03;Guo&Guthrie‘05)。即使是疏水性的化合物也显示出了良好的与文献报道结果的一致性:TerfenadineIC50=25nM、Bepredil IC50=54nM 以及Astemizole IC50=15nM。
hERG 通道的药物效应高通量筛选在药物安全性实验中起到至关重要的作用。化合物高效数据的获取显示了IonFlux 在hERG 筛选和化合物特性分析方面是一值得拥有的高效工具。
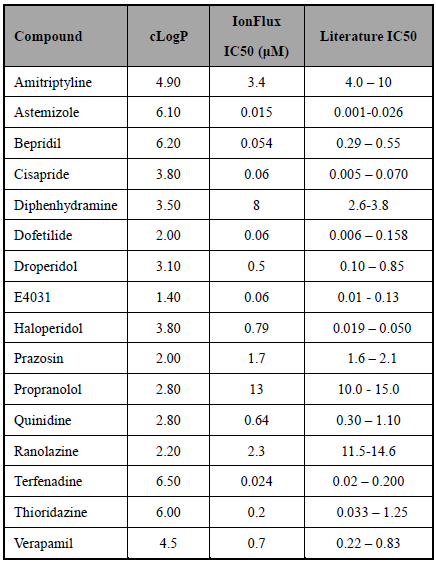
Table 1. IonFlux 系统记录的多个已知hERG 抑制剂的IC50 值与文献报道的结果(右侧)的比较表。cLogP 值反应了相应化合物的疏水性。
参考文献
Curran ME, et al. (1995). Cell 80, 795-803
Dubin AE, et al. (2005) J Biomol Screen 10:168-81
Guo L & Guthrie H. (2005) J Pharmacol Toxicol Methods 52:123-35
Moss AJ, et al. (2002) Circulation 105:794-799
Redfern WS, et al. (2003) Cardiovasc Res 58:32-45
Sanguinetti MC et al. (1995). Cell 81:299-307
Tanaka T, et al.(1997) Circulation 95:565-567
Vandenberg JI, Walker BD, & Campbell TJ. (2001) Trends Phamacol Sci 22:240-246
Zhou Z, et al. (1998) Biophys J 74:230-41
